جایزه نوبل شیمی امسال، همچون جایزه نوبل فیزیک به حلقه دیگری از زنجیره فناوریهایی تعلق یافت که تصور موقعیتهای سختْ نادیدنی را برایمان فراهم کردند.

این موقعیت اما بر خلاف امواج گرانشی یا ذرات زیراتمی که زندگیهای عادی ما گویا به بود و نبودشان وابسته نیست، موقعیتی است دقیقاً بر سر جریان حیات؛ موقعیتی که چنانچه بخواهیم دقیق باشیم، باید گفت که جریان حیات تاکنون مانع از تماشای آن میشد. این موقعیت، همان آجرهای شکلدهنده به بنیان حیات است که چنانچه بخواهیم هرکدام را از زمینه آن جدا کرده و از نزدیک بررسی کنیم، بنیان حیات فروخواهد ریخت. برندگان نوبل شیمی امسال این کار را بدون آسیب رساندن به بنیان حیات صورت دادند: اقدامی که کم از یک شعبده نداشت، و در کوتاهزمانی علم بیوشیمی را به افقهایی تازه راهبر شد؛ آنقدر که دستاورد برندگان جایزه نوبل پزشکی امسال نیز در غیاب این فناوری ممکن نمیبود.
تصور کنید انسانی روبرویتان ایستاده: تصویر بدنش از طریق انعکاس نور مرئی از آن به چشم میرسد. بخشی از این امواج جذب بدن میشوند و بخش دیگرشان از آن انعکاس پیدا میکنند. بخشهای انعکاسیافته همان طول موجهایی است که به «رنگ» بدن شکل میدهند.
اما چگونه میتوان از اندامهای داخلی بدن تصویربرداری کرد؟ چنین کاری مستلزم وجود امواجی است کمانرژیتر از نور، با طول موجی بلندتر از بزرگترین واحدهای تشکیلدهنده بافت پوست، اما نه چنان کمانرژی که کاملاً جذب بافتهای داخلی بدن شوند. امواج الکترومغناطیسی چنین شروطی را برآورده نمیکنند؛ بایستی به امواج فراصوت با طول موجهایی مشخص توسل جست تا بخشی از آنها انرژی کافی برای انعکاس از اندامهای داخلی بدن را داشته باشند. این امواج همان موجهایی هستند که در فناوری سونوگرافی (یا «صوتنگاری») استفاده میشوند.
اما تصویربرداری سونوگرافیک دچار محدودیتهایی است که تفسیر تصاویر حاصله را برای افراد غیرمتخصص دشوار میکند، چراکه برای اطلاع از ماهیت سوژهای که به تصویر کشیده میشود، ضروری است تا از یک قاعده فیزیکی آگاهی داشت: هرچه طول موج امواج فراصوت بیشتر باشد، تصویر ما بافتهای بیرونیتری از بدن را با وضوح بالا به نمایش میگذارد. اما برای تصویربرداری از بافتهای درونیتر، بایستی به طول موجهایی بلندتر متوسل شد، که در اینصورت وضوح تصویر رو به کاهش خواهد گذاشت (چراکه تنها جزئیاتی با ابعاد بزرگتر از طول موج مربوطه به ثبت خواهند رسید).
تصویربرداری از داخلیترین بافت بدن، استخوان، محدودیتهایی یکسره متفاوت دارد: یک موج برای رسیدن به استخوان، بایستی طول موجی به حد کافی بلند داشته باشد؛ اما در اینصورت انرژی آن کفاف انعکاس از استخوان را نخواهد داد و تماماً جذب بدن خواهد شد. راه حل، ایجاد تصویری از طریق «سایه» استخوانهاست، با شلیک موجی که انرژیاش تنها کفاف عبور از بافتهای پیرامون استخوان را بدهد، نه بافت استخوان؛ که در اینصورت بار دیگر بایستی از یک موج الکترومغناطیسی مدد جست: پرتوهای ایکس.
این سلسلهمراتب از فناوریهای تصویربرداری – از فناوری عکاسی با نور مرئی گرفته تا فناوریهای سونوگرافی و رادیولوژی – بر تنها دو گونه برهمکنش نور با سوژه مبتنیاند: انعکاس و جذب. اما در نیمه نخست قرن بیستم، برای تصویربرداری از ساختارهایی کوچکتر از حتی ظریفترین بافتهای بدن (ساختارهایی همچون مولکولها)، از گونه سومی از برهمکنش نور با سوژه استفاده میشد: پَراش (diffraction). در این تکنیک، ابتدا پرتوهای ایکس به سمت یک مولکول شلیک میشوند، و پس از برهمکنش با الکترونهایشان تغییر زاویه میدهند (فرآیندی موسوم به پَراش). از شدت و جهت این تغییر زاویه میتوان به تراکم الکترونهای مولکول پی برد و بدینوسیله درکی از موقعیت اتمهای سازندهشان حاصل کرد.
اما طی فرآیند پراش، بسیاری از پرتوهای خروجی بر اثر تداخل با یکدیگر خنثی میشوند؛ حالآنکه برای اطلاع از ساختار مولکول لازم است ابتدا شرایطی را برای تداخل «تقویتکننده» پرتوهای خروجی فراهم کرد (در این انیمیشن، الگوی تداخل تقویتکننده دو موج را میتوان به شکل تودههای زرد و آبی مشاهده کرد). از همین رو ضروری است تا به جای شلیک پرتوهای ایکس به تودهای نامنظم از مولکولها در شرایط طبیعیشان، این پرتوها را روانه چیدمانی جامد و منظم از آن مولکولها کرد، یعنی «بلور»هایی از آنها. از همین رو به این شیوه تصویربرداری از ساختارهای مولکولی اصطلاحاً «بلورنگاری» (crystallography) گفته میشود.

ریچارد هندرسون، از برندگان نوبل شیمی امسال که درجه دکتری خود را در سال ۱۹۶۹ در رشته بلورنگاری پرتو ایکس از دانشگاه کیمبریج اخذ کرد، این روش را برای تصویربرداری از ساختار پروتئینها به کار گرفت. اما در بررسی یک «پروتئین غشایی» به مشکل برخورد. این پروتئینها تنها در احاطه غشای پیرامون یک سلول زنده در وضعیت عادی خود به سر میبرند؛ بهطوریکه چنانچه از این محیط خارج شوند، به صورت تودههایی بیشکل به هم خواهند چسبید. سالها تلاش هندرسون برای فرآوری یک ساختار بلوری از پروتئینهای غشایی به بنبست خورد. سرانجام به سراغ تنها گزینه دیگر موجود در آن مقطع رفت: میکروسکوپ الکترونی.
میکروسکوپهای الکترونی به جای تاباندن پرتوهای الکترومغناطیسی به سمت سوژهشان، پرتوهایی از الکترون را شلیک میکنند. طول موج اسمی ِ بسیار کوتاهتر الکترونها در نسبت با نور مرئی، امکان تصویربرداری از اجسامی به ریزی اتمها را نیز خواهد داد، اما فقط در صورتیکه موج الکترون با حداکثر قدرت ممکن به سمت سوژه شلیک شود. این تبصره، استفاده از میکروسکوپهای الکترونی برای بررسی مولکولهای زیستی (چنانکه در بدن عمل میکنند) را تقریباً منتفی میکرد، چراکه در صورت برخورد یک پرتوی الکترونی به این مولکولها، «مرگ»شان حتمی بود. به علاوه، سوژه میکروسکوپهای الکترونی میبایست در محیط خلأ قرار میگرفت؛ محیطی که بلافاصله موجب تبخیر آب موجود در مولکولهای حیاتی میشد. این بنبست، ظاهراً عبورناشدنی بود. اما پروتئین خاصی که هندرسون از قضا برای تحقیقات خود انتخاب کرده بود، خودْ کلیدی شد برای عبور از این بنبست: پروتئین «باکتریورودوپسین».

گام هندرسون: وضوح بهتر
باکتریورودوپسین پروتئینی است ارغوانیرنگ که در غشای ارگانیسمهای فتوسنتزکننده یافت میشود و به جذب انرژی پرتوهای خورشید کمک میکند. هندرسون و همکارانش به جای جداسازی این پروتئین از غشای محاط بر آن، کل غشای محتوی پروتئین را در زیر میکروسکوپ الکترونی قرار دادند، و به منظور پیشگیری از تبخیر آب موجود در غشاء نیز آن را با محلولی از گلوکز پوشاندند. تنها مشکل باقیمانده، قدرت موج الکترونی بود. خوشبختانه از آنجاکه چیدمان باکتریورودوپسینها در غشای پیرامونشان نسبتاً منظم است و همه در یک راستا قرار دارند، تصمیم بر این شد تا شدتجریان موج الکترونی کاهش داده شود. این موضوع اگرچه وضوح تصویر را به شدت کاهش میداد، اما به یمن چیدمان منظم این پروتئین خاص، میشد از طریق ثبت الگوی پراش الکترونها از پروتئین، تصویری غیرمستقیم از آن به ثبت رساند. به عبارت دیگر، رویکرد ریاضیاتی تیم هندرسون به این شیوه تصویربرداری، دقیقاً مشابه رویکردی بود که در بلورنگاری پرتو ایکس استفاده میشود. در گام بعد، آنها موج الکترونی را از زوایای مختلف به سمت غشاء شلیک کردند و با تلفیق این تصویربرداریهای دوبعدی، موفق به تهیه تصویری سهبعدی از یک باکتریورودوپسین شدند.
این تصویر با رزولوشن ۷ آنگستروم (معادل ۷ به توان منفی ۱۰ متر)، در آن مقطع دقیقترین تصویر یک پروتئین از زیر یک میکروسکوپ الکترونی بود. اما هدف هندرسون، استحصال تصویری بود به وضوح تصاویر حاصل از بلورنگاری پرتو ایکس؛ تصاویری با رزولوشن ۳ آنگستروم. پیشرفت تدریجی میکروسکوپهای الکترونی بخشی از راه نیل به چنین هدفی را هموارتر کرد. این پیشرفت از طرفی شامل ارتقای کیفیت عدسیها و اپتیک میکروسکوپهای الکترونی میشد، و از طرف دیگر افزوده شدن تکنیکهای تبرید (یا سردسازی) نمونهها از طریق نیتروژن مایع به منظور کاهش آسیب ناشی از برخورد پرتوهای الکترونی پرانرژیتر به نمونهها. بدینوسیله به یمن تولید «میکروسکوپهای الکترونی تبریدی»، هندرسون موفق شد تا پانزده سال پس از موفقیت اولیهاش در تهیه تصویری سهبعدی از یک باکتریورودوپسین، عاقبت رؤیای خود را با تلاش بسیار محقق سازد: تهیه تصویری از این پروتئین با رزولوشن اتمی.
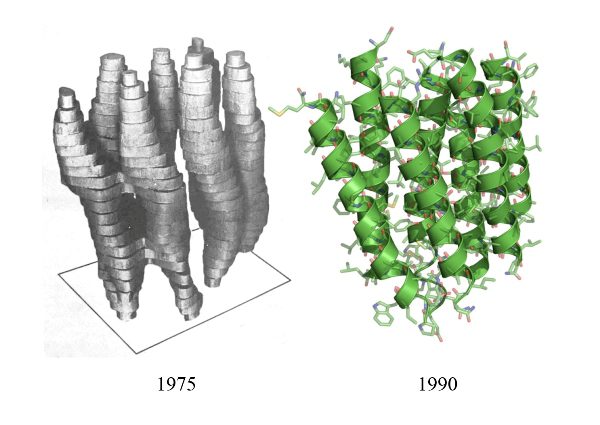
اما رؤیاهای دیگری در کار بود. باکتریورودوپسین یک پروتئین استثناست، با چیدمانی منظم و ساختار مشخص. اما بخش اعظم پروتئینها اینچنین نیستند. چیدمانشان در غشای پیرامون، تابع هیچگونه نظم بهخصوصی نیست و نمیتوان برای تهیه تصویری دقیق از آنها به الگوریتمهای بلورنگاری پرتو ایکس متوسل شد. آیا راهی برای تعمیم راهبرد هندرسون جهت تصویربرداری دقیق از چنین پروتئینهایی هم وجود داشت؟ بیوشیمدانان تحقق چنین رؤیایی را تقریباً محال میدانستند. یوآخیم فرانک موافق نبود. این بیوفیزیکدان آلمانیتبار، از ده سال پیش به فکر تحقق چنین رؤیایی بود؛ همزمان با همان موقعی که هندرسون موفق به تهیه تصویر ۷-آنگسترومیاش از یک باکتریورودوپسین شد. پیشرفتهای فناوری از آن دوران، تنها شامل حال میکروسکوپهای الکترونی نمیشد؛ الگوریتمهای کامپیوتری نیز در این بین پیشرفت کرده بودند، و موسم ثمردهی ایدههای درخشان فرانک نزدیک و نزدیکتر میشد.
گام فرانک: آنالیز بهتر
تدارکات فیزیکی راهبرد فرانک اساساً تفاوتی با شیوه تصویربرداری هندرسون نداشت. اما از دید الگوریتمی که فرانک برای آنالیز دادههای حاصل از پراش پرتوهای الکترونی تمهید دیده بود، تفاوتی نمیکرد که چیدمان پروتئینهای درون غشاء منظم باشد یا نامنظم. واضح است که پروتئینهای درون غشاء همه از یک نوعاند؛ لذا تفاوت بین الگوهای پراش برمیگردد به جهتگیری پروتئینها. میشد انتظار داشت که از بین کلیه الگوهای پراش ایجادشده در نتیجه شلیک یک پرتوی الکترونی به درون غشاء، برخی الگوها به یکدیگر شبیهتر باشند؛ یعنی الگوهای مربوط به پروتئینهایی که تصادفاً همجهتاند. الگوریتم کامپیوتری فرانک قادر بود ابتدا این الگوهای مشابه را در دستههای مجزا جا دهد؛ هر دسته به ازای یک تصویر دوبعدی از پروتئین از یک زاویه خاص. سپس نسبت متقابل بین این تصاویر دوبعدی در یک فضای سهبعدی شبیهسازی میشد؛ و بدینوسیله تصویری واضح از ساختار سهبعدی پروتئین به دست میآمد.

اولین تلاش موفق فرانک، ایجاد مدلی سهبعدی از سطح یک ریبوزوم بود؛ سازه مولکولی عظیمی که عهدهدار وظیفه تولید پروتئینها در سلول است. این موفقیت، گامی بلند در فرآیند پیشرفت فناوری میکروسکوپهای الکترونی تبریدی به شمار میرفت. حال، فقط یک مسأله باقی بود تا حل آن نهایتاً رؤیای تصویربرداری سهبعدی از مولکولهای حیاتی در حین فعالیت را برآورده سازد: پیشگیری از تبخیر آب درون غشاء حین قرارگیری نمونهها در معرض خلأ میکروسکوپ الکترونی. راهبرد اولیه هندرسون برای حل این مشکل (یعنی پوشاندن غشاء با لایهای از گلوکز) تنها برای مولکولهای زیستی غیرحلال در آب (همچون باکتریورودوپسین) جوابگو بود. اما تبخیر آب پیرامون یک مولکول زیستی حلال در آب عملاً موجب از دست رفتن مولکول میشد.
پژوهشگران بسیاری کوشیده بودند از طریق انجماد آب درون غشای سلول، به تصویری واضح از مولکولهای زیستی درون آن برسند؛ چراکه یخ در نسبت با آب در محیط خلأ مقاومتی بیشتر از خود نشان میدهد. اما شدت بالای پراش پرتوهای الکترونی در برخورد با بلورهای یخ، الگوهای پراش مولکولهای هدف را تحتالشعاع قرار میداد و تصویر حاصله، تصویری میشد عملاً بیمصرف.
تقریباً همزمان با شروع کار هندرسون و فرانک بر روی پروژههای مستقلشان، ژاک دوبشه، بیوفیزیکدان سوئیسی در آزمایشگاه زیستشناسی مولکولی اروپا واقع در هایدلبرگ آلمان، مستقلاً به فکر عبور از همین بنبست نهایی بود.
گام دوبشه: کنتراست بهتر
راه حل دوبشه نیز اساساً انجماد آب درون غشاء را مبنا قرار میداد، اما با سرعتی بیشتر. ایده آن بود که آب چنان سریع منجمد شود که مولکولهای آن فرصت بازآیی خود را به شکل بلورهای یخ نداشته باشند. نتیجهاش ایجاد آبی میشد جامد اما در همان وضعیت مایع؛ همچون فریمی از یک فیلم. این فرآیند – موسوم به شیشهای شدن (virtification) – مولکولهای آب را در وضعیتی بینظم ثبات میبخشد، بهطوریکه که با پراش یکنواخت پرتوهای الکترونی، پسزمینهای نسبتاً خنثی برای تصویر نهایی ایجاد خواهد شد.
تیم دوبشه نخست کوشیدند غشای سلولی را با نیتروژن مایع (در دمای منفی ۱۹۶ درجه سانتیگراد) سرد کنند، اما تنها وقتی به نتیجه مطلوب رسیدند که نمونه را در ظرفی محتوی اتان مایع قرار دادند که خود با نیتروژن مایع سرد میشد. نتیجه حیرتآور بود؛ آنها برای نخستین بار شاهد فراوانترین حالت آب در عالم بودند: آب شیشهایشده.
این روش به مرور زمان بهبود یافت. نمونهها نخست در آب حل میشدند. سپس قطرهای از محلول بر روی یک تور فلزی پخش میشد تا غشایی از آن فضای مابین حفرههای تور را پر کند. تور در اتان مایع فرومیرفت، و بلافاصله پس از شیشهای شدن آب درون غشاء و «انجماد» فرآیندهای مولکوی جاری در آن، روانه محیط خلأ یک میکروسکوپ الکترونی میشد. پرتوهای الکترونی به سمت منافذ تور شلیک میشدند، و سرانجام تصویر نهایی حاصل میشد. اولین تصویر تیم دوبشه از این طریق، از اجتماعی از ویروسها بود که در سال ۱۹۸4 تهیه شد؛ تصویری با رزولوشن نهچندان راضیکننده 4۰ آنگستروم.

بدینوسیله تا اواخر دهه ۱۹۹۰، هر سه گام ضروری برای تبدیل فناوری میکروسکوپ الکترونی تبریدی به ابزاری برای تصویربرداری از مولکولهای اساسی حیات فراهم شده بود. با اینهمه، رزولوشن تصاویر همچنان تا رزولوشن مطلوب فاصله داشت. به یمن پیگیریهای مثالزدنی هندرسون، وضوح تصاویرْ آنگستروم به آنگستروم افزایش یافت تا سرانجام در سال ۲۰۱۳، نخستین تصاویر حاصل از این فناوری با رزولوشن اتمی تهیه شود.

در سال ۱۹۷۵ که هندرسون از اکتفاء به روشهای بلورنگاری پرتو ایکس روی گرداند و پا در این مسیر چهلساله نهاد، پژوهشگری نوشته بود “اگر بنا به تحقق چنین روشهایی باشد، به قول یک دانشمند، دیگر هیچ حد و مرزی در میان نخواهد بود.” حال، حد و مرزها هرگز به کمرنگی امروز نبودهاند. اگرچه همچنان بررسی پروتئینهای ساده مستلزم توسل به فناوریهای سابق است، درک فرآیندهای مولکولی پیچیدهای که در سطوح عالیتر حیات رخ میدهد – همچون بنیان مولکولی فرآیند تنظیم ساعت زیستی موجودات، که جایزه نوبل پزشکی امسال را به خود اختصاص داد – تنها به یمن دستاوردهای هندرسون، فرانک، و دوبشه، با رزولوشنی مطلوب امکانپذیر شده است. صنعت داروسازی نیز از دیگر حوزههای برجستهای است که از خدمات این سه پژوهشگر و همکارانشان منتفع شده است. مقابله با شیوع گسترده ویروس مهلک زیکا در سالیان ۲۰۱۵ و ۲۰۱۶، بدون شناخت ساختار این ویروس از طریق فناوری میکروسکوپ الکترونی تبریدی امکانپذیر نمیبود.
هندرسون، فرانک، و دوبشه به حق انتخابی شایسته برای دریافت جایزهای بودند که به وصیت بانی آن، از آن کسانی که “بزرگترین منفعت را به بشریت” رساندهاند.


بسیارمطلب عالی وقابل استفاده ای بود که به زبانی ساده وقابل فهم غیرمتخصصان نوشته شده بود.ازنویسنده وگردانندگان رادیوزمانه سپاسگزارم
فریبرزموجبی / 19 October 2017